Цель занятия: Познакомиться с принципами работы и использования приборов специальной микроскопии в исследовательских целях. Закрепить навык микроскопирования гистологического препарата.
¨ Задание:
1. Заполните таблицу 2, отметив основные виды микроскопии, их разновидности, кратко сформулируйте цели использования каждой разновидности.
Методы и техника микроскопирования
| Виды микроскопии | Разновидности | Цели использования |
1. Световая микроскопия.Применяются обычные световые микроскопы и их разновидности, в которых используются источники света с различными длинами волн. В световом микроскопе можно видеть не только отдельные клетки размером от 4 до 150 мкм, но и их внутриклеточные структуры – органеллы и включения. Для усиления контрастности микрообъектов применяют их окрашивание.
а) Ультрафиолетовая микроскопия.Используются более короткие ультрафиолетовые лучи с длинной волны около 0,2 мкм. Полученное невидимое глазом изображение преобразуется в видимое с помощью регистрации на фотопластинке или путем применения специальных устройств (люминесцентный экран, электронно-оптический преобразователь).
б) Флюоресцентная (люминесцентная) микроскопия.Суть метода заключается в том, что атомы и молекулы ряда веществ, поглощая коротковолновые лучи, переходят в возбужденное состояние. Обратный переход из возбужденного состояния в нормальное происходит с испусканием света, но с большей длиной волны. Применяются ртутные и ксеоновые лампы сверхвысокого давления, обладающие высокой яркостью в области ближних ультрафиолетовых и сине-фиолетовых лучей. Любая клетка живого организма обладает собственной флюоросценцией (часто довольно слабой).
— Первичная флюоресценция – обладают серотонин, катехоламины (адреналин и норадреналин), содержащиеся в нервных, тучных и других клетках, после фиксации тканей в парах формальдегида (метод Фалька).
— Вторичная флюоресценция возникает при обработке препаратов специальными красителями – флюорохромами.
в) Фазово-контрастная микроскопия.Этот методслужит для получения контрастных изображений прозрачных и бесцветных живых объектов, невидимых при обычных методах микроскопирования. Для этого неокрашенные структуры помещают в кольцевую диафрагму, помещаемую в конденсоре, и фазовой пластинки, находящейся в объективе. Такая конструкция оптики дает возможность преобразовать не воспринимаемы глазом фазовые изменения прошедшего через неокрашенный препарат света в изменение его амплитуды, т.е. яркости получаемого изображения.
г) Микроскопия в темном поле.Достигает объективатолько свет, который дает дифракцию структур в препарате. В микроскопе есть специальный конденсор, который освещает препарат строго косым светом. Таким образом, поле выглядит темным, а мелкие частицы в препарате отражают свет, который далее попадает в объектив. Этот метод используется для изучения живых объектов, например зерен серебра, которые выглядят светлыми на темном поле. В клинике его применяют для изучения кристаллов в моче (мочевая кислота, оксалаты), для демонстрации спирохет и т.д.
д) Интерференционная микроскопия.Используется дифференциальный интерференционный микроскоп (с оптикой Номарского), который используют для изучения рельефа поверхности клеток и других биологических объектов.
В этом микроскопе пучок света от осветителя разделяется на два потока: один проходит через объект и изменяет по фазе колебания, второй идет, минуя объект. В призмах объектива оба пучка соединяются и интерферируют между собой. В результате строится изображение, в котором участки микрообъекта разной толщины и плотности различаются по степени контрастности. Проведя количественную оценку изменений, определяют концентрацию и массу сухого вещества.
Преимущество такой микроскопии является возможность наблюдать клетки в процессе движения и митоза. При этом регистрация движения клеток может производиться с помощью покадровой микрокиносъемки.
е) Темнопольный микроскоп применяется для получения изображений прозрачных живых объектов. Образец в нем рассматривается при столь «косом» освещении, что прямой свет не имеет возможности попасть в объектив. Изображение формируется светом, дифрагированным на объекте, и в результате объект выглядит очень светлым на темном фоне (с очень большим контрастом).
2. Поляризационная микроскопия.Поляризационный микроскоп является модификацией светового микроскопа, в котором установлены два поляризационных фильтра – первый (поляризатор) между пучком света и объективом, а второй (анализатор) между линзой объектива и глазом. Оба фильтра могут вращаться, изменяя направления пучка света. Структуры, содержащие продольно ориентированные молекулы (коллаген, микротрубочки, микрофиламенты), и кристаллические структуры (в Лейдига – гландулоциты яичка) при изменении оси вращения проявляются как светящиеся. Способность кристаллов или паракристаллических образований к раздвоению световой волны на обыкновенную и перпендикулярную к ней называется двойным лучепреломлением. Такой способностью обладают фибриллы поперечно-полосатых мышц.
3. Электронная микроскопия.Рассматривая характеристики светового микроскопа, можно убедиться, что единственным путем увеличения разрешения оптической системы будет использование источника освещения, испускающего волны с наименьшей длиной. Таким источником может быть раскаленная нить, которая в электрическом поле выбрасывает поток электронов, последний можно фокусировать, пропуская через магнитное поле. Это послужило основой для создания электронного микроскопа, в котором уже сейчас достигнуто разрешение в 0,1 нм. По принципу конструкции электронный микроскоп очень сходен с оптическим: в нем есть источник освещения (катод электронной пушки), конденсорная система (конденсорная магнитная линза), объектив (объективная магнитная линза), окуляр (проекционные магнитные линзы), только вместо сетчатки глаза электроны попадают на люминесцирующий экран или на фотопластинку. В электронном микроскопе используется поток электронов, с более короткими, чем в световом микроскопе, длинами волн. Разрешаемое расстояние в 100 000 раз меньше, чем в световом микроскопе. В современных электронных микроскопах разрешаемое расстояние составляет около 0,1-0,7 нм.
В настоящее время используются трансмиссионные и сканирующие электронные микроскопы, которые имеют большую глубину резкости, широкий диапазон непрерывного изменения увеличения (от 10-ков до 10-ков тысяч раз) и высокая разрешающая способность.
2. Рассмотрите строение светового микроскопа. Повторите правила работы с ним.
Работа с микроскопом. Устройство типичного биологического микроскопа (рис.1). Штативная подставка выполняется в виде тяжелой отливки. К ней на шарнире прикреплен тубусодержатель, несущий все остальные части микроскопа.
С помощью тубуса, в который вмонтированы линзовые системы, можно перемещать их относительно образца для фокусировки. На нижнем конце тубуса расположен объектив.
Как правило, микроскоп снабжен несколькими объективами разного увеличения на револьверной головке, которая позволяет устанавливать их в рабочее положение на оптической оси. При исследовании образца оператор обычно начинает с объектива, который имеет наименьшее увеличение и наиболее широкое поле зрения, находит интересующие его детали, после чего рассматривает их, пользуясь объективом с большим увеличением.
Окуляр вмонтирован в конец выдвижного держателя, при помощи которого можно при необходимости изменять длину тубуса. Передвигая вверх и вниз весь тубус с объективом и окуляром, микроскоп наводится на резкость.
В качестве образца обычно берется очень тонкий прозрачный слой или срез, который кладут на стеклянную пластинку прямоугольной формы, называемую предметным стеклом, а сверху накрывают более тонкой стеклянной пластинкой меньших размеров, которая называется покровным стеклом. Чтобы увеличить контраст, образец часто окрашивают химическими веществами.
Предметное стекло кладут на предметный столик таким образом, чтобы образец находился над центральным отверстием столика. Столик, как правило, бывает снабжен механизмом для плавного и точного перемещения образца в поле зрения.
Третья система линз – конденсор – концентрирует свет на образце. Держатель конденсоров, которых может быть несколько, находится под предметным столиком. Здесь же расположена ирисовая диафрагма для регулировки апертуры. Еще ниже находится осветительное зеркало, устанавливаемое в универсальном шарнире. За счет того, что зеркало отбрасывает свет лампы на образец оптическая система микроскопа и создает видимое изображение.
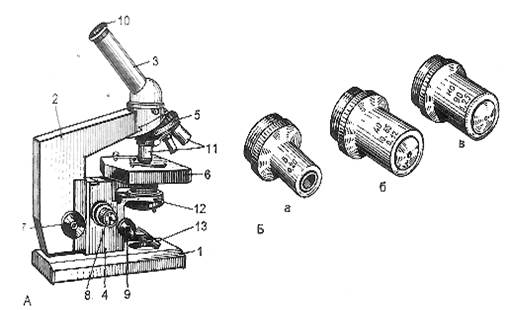
Рис. 1. Микроскоп для биологических исследований.
А-общий вид: 1 — основание; 2 – тубусодержатель; 3 – тубус; 4 – коробка механизма микроподачи; 5 – револьверное устройство; 6 – предметный столик; 7 — макрометрический винт; 8 – микрометрический винт; 9 – винт конденсора; 10 – окуляр; 11 – объективы; 12 – конденсор с ирисовой диафрагмой; 13 – зеркало; Б – объективы малого (а), большого (б) и иммерсионного (в) увеличения.
3.  Рассмотрите микропрепараты (Таблица 3), зарисуйте, подпишите. Укажите тип красителя и увеличение.
Рассмотрите микропрепараты (Таблица 3), зарисуйте, подпишите. Укажите тип красителя и увеличение.
Микроскопические методы исследования применяются для изучения
формы микробов, структуры бактериальной клетки и определении
1) Световая микроскопия.Основана на прохождении луча света через систему линза, за счет чего обеспечивается увеличение объекта в 300 раз.
2) Иммерсионная микроскопия.Основана на использовании
иммерсионного масла, преломляющая способность которого равна
преломляющей способности стекла. За счет этого световые лучи не
рассеиваются, как в световом микроскопе, а попадают в объектив,
обеспечивая хорошее освещение.
3) Фазово-контрастная микроскопия.Основана на превращении изменений по фазе, возникающая при расхождении луча света через прозрачные объекты.
4) Темнопольная микроскопия.Основана на дифракции света при
сильном освещении взвеси мельчайших частиц в жидкости.
5) Люминесцентная микроскопия.Основана на воздействии действии
флюорохромов на клеточные компоненты бактерий.
6) Электронная микроскопия.Основное отличие электронной от
световой микроспории заключается в том, что в нем вместо света
используется быстрый поток электронов, а стеклянные линзы
заменены электромагнитными полями.
Разрешающая способность микроскопа– минимальное расстояние между двумя точками, на котором они воспринимаются раздельно. Для светового микроскопа рс=0,2 мкм.
Степень увеличения микроскопа– это произведение увеличения линз окуляра на увеличение линз объектива.
2. АГ: определение, хим. Природа, строение, виды, свойства
В осуществлении иммунной защиты участвуют 3 вида клеток: фагоциты, Т- и В-лимфоциты. Деятельность этих клеток направлена на распознавание и уничтожение чужеродных агентов — антигенов.
Антигены обладают двумя основными свойствами:
1) антигенностью. Это способность вызывать в организме выработку антител.
Антигенность вещества зависит от его чужеродности, от величины и сложности строения молекулы, от его растворимости. Все эти свойства присущи белкам или белковой части антигена;
2) специфичностью — выражается в способности антигенов взаимодействовать только с теми антителами, которые выработались в ответ на введение данного антигена. Специфичность антигена определяется небольшим участком молекулы — детерминантной группой. Количество этих групп может быть разным. Их функции выполняют углеводы, пептиды, липиды, нуклеиновые кислоты.
3. возбудитель туляремии
1. Вирусы: определение, морфология, ультраструктура, классификация.
Вирусы — это организмы, не способные существовать и размножаться самостоятельно. В определении вируса подчеркивается особая природа их паразитизма, который можно назвать паразитизмом на генетическом уровне. Тот факт, что вирусы способны выживать и размножаться только внутри других клеток, объясняется не отсутствием собственной клеточной организации, а их потребностью в поступлении готовых источников питания. Если бактерии обладают способностью расти и размножаться на искусственных питательных средах, то вирусы, напротив, как настоящие клеточные паразиты, полностью зависят от обмена веществ в клетке-хозяине. Сейчас уже доказано, что отношение вирус—хозяин не ограничивается лишь питанием, а носит более сложный характер.
Когда стали возможны современные методы исследования, с помощью электронного микроскопа удалось выявить детали структуры вирусов.
От бактерий вирусы отличаются простотой строения. Они состоят из нуклеиновой кислоты и белковой оболочки, которая называется «капсид». Нуклеиновые кислоты представляют собой необходимый элемент живой материи, главное
назначение которого — сохранять и переносить наследственную, или генетическую, информацию. Нуклеиновая кислота состоит из большого числа структурных единиц — нуклеотидов. Каждый нуклеотид состоит из трех основных частей: молекулы фосфорной кислоты, молекулы сахара и молекулы органического основания. Органические основания представлены следующими веществами: цитозином, тимином, урацилом, аденином и гуанином. По типу сахара, содержащегося в нуклеиновых кислотах, различают два вида кислот. В одной из них нуклеотиды содержат рибозу, и тогда кислота называется рибонуклеиновой (РНК), а в другой — дезоксирибозу и кислота называется дезоксирибонуклеино-вой (ДНК). Вирусы всегда содержат лишь одну из двух кислот: либо РНК, либо ДНК. В бактериях и других живых клетках ДНК в основном содержится в ядре, а РНК локализуется в цитоплазме и ядрышке клетки. Нуклеиновые кислоты вирусов состоят из одной или двух спиралей.
Вирусы способны поражать многие живые организмы: бактерии, растения, человека и животных. Например, цветковые растения являются хозяевами для многих типов вирусов. Наука — фитопатология занимается в том числе изучением вирусных болезней картофеля, бобов, свеклы, сахарного тростника и других сельскохозяйственных культур.
Среди беспозвоночных вирусные болезни обнаружены только у насекомых. Среди позвоночных известны вирусные заболевания у рыб, амфибий (опухоль почки у леопардовой лягушки). Многие вирусные заболевания известны у птиц (саркома и лейкозы служат излюбленной моделью при изучении вирусной природы опухолей). К вирусным заболеваниям человека относятся: грипп, корь, полиомиелит, бешенство, краснуха и многие другие.
Антигены многих микроорганизмов уже хорошо изучены (у сальмонелл, эшерихий, шигелл). У бактерий различают несколько видов антигенов:
1) групповые. Являются общими для двух или более видов микробов. Например, возбудители брюшного тифа имеют общие групповые антигены с возбудителями парати-фов А и В;
2) специфические антигены — имеются только у данного вида микроорганизма. Знание специфических антигенов позволяет дифференцировать микробов внутри рода и вида.
Так, внутри рода сальмонелл по комбинации антигенов дифференцировано более 1500 типов сальмонелл. По локализации антигенов в микробной клетке различают:
1) соматические, О-антигены — связаны с телом микробной клетки. О-антиген высокотоксичен (является эндотоксином грамотрицательных микроорганизмов), термостабилен (не разрушается даже при кипячении). Однако соматический антиген разрушается под действием формалина и спиртов;
2) жгутиковые, Н-антигены — имеют белковую природу и находятся в жгутиках подвижных микроорганизмов. Н-антигены быстро разрушаются при нагревании;
3) капсульные, К-антигены — расположены на поверхности микробной клетки и называются еще поверхностными. Наиболее детально эти антигены изучены у кишечной группы бактерий. У них различают Vi-, M-, В-, L- и А-антигены. При иммунизации человека коплексом Vi-антигена наблюдается высокая степень защиты против брюшного тифа. Наибольшая термостабильность характерна для группы А — они не разрушаются даже при длительном кипячении. Группа В выдерживает нагревание до 60°С около 1 часа, группа L быстро разрушается при такой же температуре.
Антигенными свойствами обладают также бактериальные токсины, ферменты, белки, которые секретируются бактериями в окружающую среду. При взаимодействии со специфическими антителами эти антигены теряют свою активность.
По иммуногенности антигены бывают полноценными и неполноценными.
Полноценные антигены обладают способностью вызывать образование антител в организме и вступают с ними в специфическое взаимодействие. Такие антигены имеют большую молекулярную массу, большой размер молекулы и хорошо взаимодействует с факторами иммунитета. Результат этого взаимодействия можно наблюдать в пробирке. Под влияни-
ем антител микробы могут склеиваться и оседать на дно пробирки, эта реакция называется реакцией агглютинации.
Неполноценные антигены обладают низкой иммуноген- ] ностью и не вызывают образования антител в организме, но они становятся полноценными, если соединятся с белками ] организма.
Существует несколько путей проникновения антигенов в
Ф через кожные покровы и слизистые оболочки в результате их повреждения (укусы насекомых, ранения, микротравмы и т. д.); путем всасывания в ЖКТ;
* межклеточно (при незавершенном фагоцитозе, при внутриклеточном паразитировании микроорганизм может разноситься по всему организму). Проникнув в организм, микроб разносится по всем органам и тканям с током крови или лимфы. Процесс проникновения антигена и его контакт с иммунной системой протекают поэтапно, постепенно.
3. Возбудитель столбняка
1. Основные стадии репродукции вируса в клетке хозяина. Особенности репродукции ЖК-вирусов
Взаимодействие вируса с клеткой хозяина — это сложный многоступенчатый процесс, который начинается с адсорбции вирусных частиц на рецепторах клетки хозяина и продолжается после их проникновения внутрь клетки. В результате такого взаимодействия развивается либо продуктивная, либо абортивная, либо интегративная форма клеточной инфекции. При п р.о дуктивной форме происходит размножение, точнее репродукция (лат. reproduce—воспроизводить) вируса, при абортивной — ее нарушение на одном из этапов, при и н-тегративной — интеграция вирусной нуклеиновой кислоты в клеточный геном.
РЕПРОДУКЦИЯ ВИРУСОВ
Как отмечалось выше, вирусы являются самореплицирующейся формой, неспособной к бинарному делению, в отличие от микроорганизмов с клеточной организацией. В 50-х годах было установлено, что размножение, или репродукция, вирусов происходит путем репликации их нуклеиновой кислоты и биосинтеза белков с последующей самосборкой вириона. Этот процесс происходит в разных частях клетки — ядре или цитоплазме,
Последнее изменение этой страницы: 2016-09-05; Нарушение авторского права страницы
Основными характеристиками микроскопа являются общее увеличение и разрешающая способность.
Общее увеличение не характеризует качества изображения, которое может быть четким и нечетким.
Четкость получаемого изображения определяется разрешающей способностью микроскопа, т.е. той наименьшей величиной объектов или их деталей, которые можно увидеть с помощью этого прибора. Разрешающая способность зависит от длины проходящего через объект света, показателя преломления оптической среды (показатель преломления воздуха равен 1,0; иммерсионного масла – 1,516; стекла –1,520) и апертурного угла объектива. Эту зависимость вывел немецкий физик Эрнст Аббе во второй половине XIX века:
d = l / 2 n sin a,
где: d – минимальное расстояние между двумя точками, видимыми раздельно;
l — длина волны света, проходящего через исследуемый объект;
n sina — числовая апертура, где n –показатель преломления светом оптической среды, a — апертурный угол объектива.
На рис.2 представлена схема, иллюстрирующая понятие апертурного угла микроскопа (стрелками обозначен ход световых лучей).
 р р 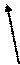   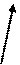            1 1  a 2 g a 2 g    4 4   р1 р1 |
g — отверстный угол; a — апертурный угол; 1 – фронтальная линза объектива; 2 – пространство между объектом и объективом; 3 – предметное стекло с объектом; 4 — конденсор; 5 — диафрагма; рр1 — главная оптическая ось |
Рис. 2 Схема, иллюстрирующая понятие апертурного угла
Э. Аббе доказал, что нет смысла беспредельно повышать увеличение светового микроскопа. Минимальное расстояние между двумя точками при освещении объекта светом с длиной волны 550 нм, к которому наиболее чувствителен глаз, при использовании микроскопа, апертурный угол которого 90 0 (это предельный угол для которого sina=1), для сухой системы составляет около 300 нм, а для иммерсионной системы – около 200 нм.
Таким образом, повысить разрешающую способность микроскопа можно путем:
— снижения длины волны света, проходящего через объект;
— использования иммерсионной системы;
— повышения апертурного угла до предельного (до 90 0 ).
Микроскопия в темном поле
Используется для исследования слишком малых и слабоконтрастных живых объектов. При микроскопии этим методом используют специальный конденсор темного поля, центр которого затемнен. Поэтому центральный пучок световых лучей не попадает в объектив и поле зрения микроскопа остается темным. Объект освещается только лучами, попадающими на него под углом. Рассеиваясь на объекте, часть лучей изменяет направление и попадает на объектив. Объект становится видимым как светящаяся точка на темном фоне. Метод темного поля позволяет получить представление о внешней форме живых неокрашенных объектов и их движении.
Микроскопия в темном поле позволяет увеличить разрешающую способность объектива примерно в 10 раз и рассматривать объекты, размеры которых находятся за пределами обычного микроскопа. Повышение разрешающей способности достигается за счет увеличения апертурного угла.
Дает возможность изучать живые объекты без окраски и фиксирования. Глаз человека реагирует на изменения амплитуды световой волны (интенсивность, контрастность) и ее длины (цвет), но не воспринимает различий по фазе. В биологических препаратах чередуются места, которые в разной степени поглощают свет. Проходя через них, световые волны изменяют свою амплитуду. Такие участки объекта называют амплитудными, и под микроскопом они выглядят более темными. Прозрачные в видимом свете структурные элементы объектов пропускают лучи одинаковой длины и амплитуды, но смещают их фазу. Величина смещения зависит от толщины и показателя преломления структур, но видимых изменений практически не дает. Такие препараты являются неконтрастными.
С помощью фазово-контрастного устройства фазовые изменения световых волн, проходящих через прозрачные объекты, превращаются в амплитудные, благодаря чему детали рассматриваемых объектов становятся видимыми и контрастными.
Фазово-контрастное устройство дает возможность изучать структуры клеток: жгутики и оболочки бактерий, ядра и митохондрии дрожжей и грибов.
Таким образом, хотя разрешающая способность при использовании фазово-контрастной микроскопии не меняется при сравнении со светопольной, качество изображения улучшается за счет повышения контрастности.
Люминесцентная микроскопия позволяет изучать клетки в живом виде, выявлять мембранные структуры и получать высококонтрастные цветные изображения микроорганизмов.
Сущность явления люминесценции заключается в том, что некоторые молекулы структурных элементов клетки (пигменты, витамины, алкалоиды и др.) способны поглощать часть энергии падающего света определенной длины волны, переходить в электронно-возбужденное состояние и испускать свет с другой длиной волны. Источником возбуждения могут быть ультрафиолетовые лучи (300-400 нм) и видимый свет коротковолновой области спектра (400-460 нм).
Клетки микроорганизмов обладают слабой собственной (первичной) люминесценцией. Ее можно усилить предварительным окрашиванием препаратов нетоксическими красителями – флуорохромами (акридин оранжевый, нейтральный красный, аурамин, флуоресцин и др.). В результате возникает вторичная люминесценция. Для ее возбуждения достаточно использовать сине-фиолетовую часть спектра. В результате возникает высококонтрастное цветное изображение рассматриваемого объекта.
Таким образом, при использовании люминесцентной микроскопии разрешающая способность микроскопа возрастает по сравнению со светопольной микроскопией за счет уменьшения длины волны проходящего через объект света.
Максимальная разрешающая способность оптических микроскопов составляет около 0,2 мкм и зависит от длины волны используемых лучей света. Увеличить разрешение в 100 и более раз можно, если вместо световых или ультрафиолетовых лучей применять поток движущихся электронов, обладающих волновыми свойствами (длина волны около 0,04 нм).
Поток электронов движется в безвоздушном пространстве от источника электронов (раскаленная нить вольфрамовой пушки) по направлению к флуоресцентному экрану и вызывает равномерное свечение его. Если же на пути электронов поместить какой-либо объект, то в зависимости от его плотности электроны будут больше или меньше задерживаться, а соответствующие места на экране окажутся более или менее затемненными. Этот простой принцип работы современного электронного микроскопа дополнен принципом отклонения электронных лучей в магнитном поле подобно тому, как световые лучи отклоняются увеличивающими стеклянными линзами. При этом используются электромагнитные линзы.
Высокая разрешающая способность современных электронных микроскопов позволяет наблюдать и изучать объекты, невидимые в оптических микроскопах: вирусы и фаги, микоплазмы, строение клеток прокариотов и эукариотов, их макро- и микроструктурные элементы. Препараты для электронной микроскопии готовят в виде очень тонких срезов на специальных ультрамикротомах или на тончайших пленках – подложках из коллодия. Следовательно, в электронных микроскопах микроорганизмы исследуют не в живом состоянии, а в виде фиксированных препаратов.
2.2 ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
На занятии студенты знакомятся с устройством микроскопа и правилами работы с ним, видами микроскопии, основными особенностями их устройства и принципами их работы. Затем они осваивают технику отбора чистых культур микроорганизмов и методику приготовления фиксированных препаратов бактерий. Готовят фиксированные препараты из чистых культур (Staphylococcus albus, Sarsina flava) и естественных мест обитания (кефира, зубного налета). Далее окрашивают эти препараты простыми методами (чистые культуры и зубной налет – фуксином, а кефир – краской Муромцева) и рассматривают их с использованием иммерсионной системы с объективом х90 или х100 при максимальном освещении.
2.2.1 Техника отбора чистых культур микроорганизмов
Отбор проб чистых культур бактерий и дрожжей, которые вырастают на поверхности плотной среды в виде мазеобразного налета или в жидкой среде ведут в следующей последовательности:
1. Зажигают спиртовку.
2. Пробирку с культурой помещают в левую руку между большим и указательным пальцами в наклонном положении. Поверхность с налетом микроорганизмов должна быть обращена вверх и хорошо видна.
3. Петлю держат вертикально в пламени горелки и прокаливают докрасна, затем наклоняют и обжигают примыкающую к ней часть петледержателя.
4. Мизинцем и безымянным пальцем правой руки прижимают к ладони наружную часть ватной пробки, вынимают ее из пробирки и держа в таком положении, не касаясь окружающих предметов.
5. Края открытой пробки обжигают в пламени горелки.
6. Осторожно вводят стерильную петлю в пробирку с культурой и охлаждают ее о стенки пробирки или прикоснувшись к питательной среде, свободной от микроорганизмов. Немного отстранив пробирку с культурой от пламени горелки, легким движением осторожно отбирают небольшое количество микробной массы с поверхности среды или каплю жидкости с клетками. Вынимая петлю из пробирки, следят за тем, чтобы отобранный материал не касался стенок и петля не оказалась над пламенем горелки.
7. Снова обжигают в пламени горелки край пробирки, затем, легким круговым движением, обжигают ватно-марлевую пробку и закрывают пробирку.
8. Пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления препарата.
9. Клетки микроорганизмов, оставшиеся не петле, сжигают в пламени горелки.
Отбор чистых культур микроскопических грибов ведут с использованием препаровальной иглы в той же последовательности, что и отбор одноклеточных организмов. Из пробирки отбирают кусочек мицелия, слегка погружая иглу в питательную среду таким образом, чтобы не нарушить структуру мицелия.
2.2.2 Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Для этого стекла, бывшие в употреблении, выдерживают 1-2 часа в хромовой смеси (в 1 л воды вносят 50 г бихромата калия и 100 г технической серной кислоты), после чего ополаскивают теплой водой и спиртом. Можно также кипятить стекла в течение 15 мин. в растворе соды или мыльной воды. Для проверки чистоты стекла на его поверхность наносят каплю воды. При достаточном обезжиривании капля растекается равномерно и не собирается в выпуклые, медленно высыхающие пузырьки. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
1. На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал, отобранный по методике, описанной в разделе 2.2.1. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем таким образом, чтобы препарат распределился на площади примерно 2…3 см 2 .
2. Полученный мазок высушивают при комнатной температуре на воздухе.
3. Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует. Цель фиксации:
— умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
— зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
— улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Приготовление фиксированных препаратов из естественных мест обитания микроорганизмов проводится так же, как и из чистых культур.
Помимо термической обработки, применяют также фиксацию химическими веществами: погружают предметное стекло с мазком в мензурку с 96 %-ным этанолом на 15-20 мин, с ацетоном на 5 мин, со смесью 96 % -ного этанола и 40%-ного формалина (соотношение 95:5) на 2 мин. и др.
2.2.3 Окраска фиксированных препаратов микроорганизмов
Фиксированные препараты нельзя рассмотреть под микроскопом, так как они являются бесцветными и пропускают световые лучи. Поэтому их окрашивают, используя простые или сложные методы.
При окрашивании фиксированных мазков простыми методами используют один краситель (фуксин, краска Муромцева, генцианвиолет, метиленовая синь и др.).
Последовательность окрашивания мазка простыми методами следующая:
1. На фиксированный препарат наносят несколько капель красителя таким образом, чтобы он покрывал всю поверхность мазка и выдерживают в течение определенного времени. Так, при окраске фуксином на мазок наносят несколько капель красителя и выдерживают его на мазке 2…3 мин. При окрашивании препарата из кефира на него краску Муромцева наносят на мазок через полоску фильтровальной бумаги на 3…5 мин.
2. Краску смывают с мазка слабой струей до бесцветной смывной воды. При этом стекло держат в наклонном положении над лотком.
3. Мазок подсушивают фильтровальной бумагой, которую осторожно прикладывают к стеклу, и досушивают на воздухе.
4. На окрашенный мазок наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100.
Оформление и анализ результатов исследований
В отчете студенты должны кратко законспектировать теоретических материал. Наблюдаемые под микроскопом картины нужно зарисовать и сделать заключение о морфологии исследованных чистых культур, а так же микрофлоры кефира и зубного налета. Под рисунками необходимо указать увеличение и подписать название изучаемого объекта.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8924 —  | 7231 —
| 7231 —  или читать все.
или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно