Химическое соединение, молекула которого состоит из одного атома азота и трех атомов водорода, называемое аммиаком (NH3), — вероятно, одно из самых известных веществ на Земле. Кто не знает про нашатырный спирт (водный аммиак) или азотные удобрения? Но мало кто осознаёт, что это ещё и источник энергии, пригодный для использования, в частности, в двигателях внутреннего сгорания. При этом требуемая доработка двигателя оказывается немногим сложнее и дороже, чем при переводе бензинового мотора на газовое топливо. Хотя по энергоёмкости единицы объёма жидкий безводный аммиак примерно вдвое уступает бензину и дизельному топливу, у него есть два неоспоримых преимущества: его можно добывать в буквальном смысле из воздуха и при его сгорании не образуется никаких токсичных соединений углерода, серы и т. п. — только азот и вода.
Энергоноситель
Использовать аммиак в качестве моторного топлива пробовали ещё 70 лет назад. Из-за острого дефицита дизельного топлива правительство Бельгии было вынуждено в 1943 г. выпустить на маршруты рейсовые автобусы, работающие на аммиаке и угольном газе. До окончания войны они успели пробежать десятки тысяч километров.

Еще одна замечательная особенность аммиака — высокое процентное содержание водорода. Как это ни парадоксально звучит, хранить и транспортировать водород в виде жидкого аммиака значительно удобнее и дешевле, чем в сжатом или сжиженном состоянии. В литре жидкого безводного аммиака содержится больше водородных атомов, чем даже в литре жидкого водорода. 37 МВт·ч энергии, которые можно высвободить при сжигании тонны водорода, «упаковываются» в 6,5 т аммиака, для хранения которых под давлением около 10 атм (давление перехода аммиака в жидкое состояние при комнатной температуре) потребуется резервуар из углеродистой стали еёмкостью 10 тыс. литров. Стоимость подобного резервуара в несколько раз меньше, чем баллонов высокого давления (свыше 200 атм), необходимых для хранения тонны сжатого водорода. Напомним, что водород требует применения специальных легированных сталей (чтобы оболочка баллона не теряла пластичности).

Другой вариант — хранение аммиака в огромных (30 тыс. м 3 ) рефрижераторных ёмкостях, охлаждаемых до температуры -33 °С, при которой он переходит в жидкое состояние под атмосферным давлением. Нетрудно заметить, она намного выше, чем -253 °С, необходимые для ожижения водорода, и, следовательно, достижима гораздо более простыми и дешёвыми средствами. Интересно, что в качестве хладагента для холодильной установки может применяться сам аммиак. Немаловажно также, что вся технология и инфраструктура производства и транспортировки аммиака как сырья для изготовления азотных удобрений давно и досконально отработаны.
Накопитель энергии
Мы уже не раз писали о том, что одна из главных задач, возникающих при организации энергоснабжения с помощью возобновляемых источников энергии (ВИЭ), — обеспечить его постоянство и бесперебойность. Все мы знаем, что солнце светит только днём и даёт хороший поток энергии только в безоблачную погоду, что ветер очень непостоянен, водообеспеченность рек зависит от осадков и т. д. Один из способов решения этой задачи — использовать энергию ВИЭ для производства топлива, с помощью которого в дальнейшем можно будет вырабатывать электроэнергию в то время, когда ВИЭ «пасуют». И аммиак — один из серьёзных претендентов на роль такого топлива.
Чтобы рассеять опасения насчёт того, что аммиак относится к классу опасных веществ (действительно, вдыхая его в больших количествах, можно в некоторых случаях получить паралич дыхания), назовём два обстоятельства. Во-первых, минимальную утечку аммиака, который имеет резкий запах, заметит даже самый нечувствительный к запахам человек. Во-вторых, аммиак почти вдвое легче воздуха, поэтому он быстро поднимается вверх, не оставляя, в отличие от других вредных газов, ядовитого облака вблизи земной поверхности.
Старый подход
Традиционно аммиак из воздуха и воды получают с применением сначала электролиза воды для получения водорода, затем — безотходного процесса Габера-Боша, когда смесь азота и водорода пропускают через нагретый катализатор под давлением около 1000 атм. При этом за счёт высокого давления равновесие в реакции N2+3H2 ↔ 2NH3 смещается вправо. Реакция образования аммиака из водорода и азота равновесная и экзотермическая (с выделением теплоты). При высоких температурах, необходимых для достижения приемлемой скорости реакции, равновесие смещается в сторону азота и водорода, из-за чего выход аммиака за один проход катализатора в промышленных условиях не превышает 14-16%. Поэтому образовавшуюся смесь охлаждают до температуры конденсации аммиака, жидкий аммиак отделяют сепаратором, а оставшуюся смесь водорода и азота направляют на рециркуляцию — вновь нагревают и пропускают через катализатор. Благодаря рециркуляции в процессе Габера-Боша теоретический выход аммиака составляет 100%. Несмотря на то, что реакция синтеза аммиака экзотермическая, процесс получается очень энергоёмким: средний расход электроэнергии на производство 1 т аммиака (без учёта электролиза) достигает 3200 кВт·ч. Энергия затрачивается на сжатие и нагрев смеси азота и водорода, а также частично рассеивается при охлаждении, необходимом для конденсации и отделения аммиака.
Новый стиль
Другой, более перспективный и экономически эффективный способ получения аммиака — так называемый твёрдотельный синтез, SSAS (Solid State Ammonia Synthesis), из водяного пара и воздуха. Здесь используется вариант обратимого твёрдооксидного топливного элемента (см. «Энерговектор» № 3/2014, с. 13) на основе трубок из протонопроводящей керамики. На одной и той же установке можно получать как аммиак из воздуха и воды с помощью электричества, так и электричество из аммиака. Проект пилотной установки такого рода разработан американской компанией Alaska Applied Sciences. Реализация проекта, по мнению авторов, позволит доказать более высокую эффективность твёрдотельного синтеза по сравнению с процессом Габера-Боша. Предполагается, что комплексная установка целиком разместится в одном перевозимом контейнере и сможет в зависимости от текущего состояния ВИЭ-генераторов либо синтезировать (на избытках вырабатываемой ими энергии) аммиак, накапливая его в резервуарах, либо генерировать из накопленного топлива недостающую энергию, подавая её в местную энергосеть. Полностью автономная необслуживаемая установка будет оснащена средствами сбора данных, системами SCADA и диспетчерского управления, чтобы обеспечить дистанционный мониторинг состояния оборудования и управление им из диспетчерского центра.
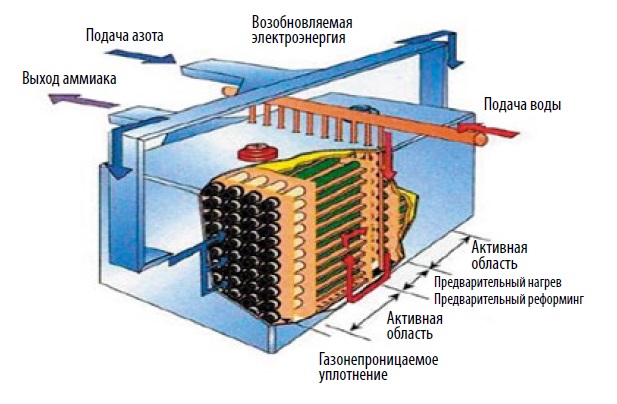
На все руки
На Аляске нет целостной энергосистемы, соединённой с Единой энергосистемой США и Канады (аналогичная картина наблюдается во многих отдалённых российских регионах). Многочисленные «островные» энергосети (причём не только на реальных океанских островах, но и на материке) часто не справляются с бесперебойной круглогодичной подачей потребителям необходимого количества электроэнергии. Кроме нескольких гидроэлектростанций, угольных ТЭС, солнечных и ветровых станций, электроэнергию для заполярного штата вырабатывают дизель-генераторы, а стоимость «северного завоза» дизельного топлива хорошо известна. Поэтому цена киловатт-часа на Аляске нередко зашкаливает за доллар, из-за чего многие местные жители вынуждены сводить потребление электроэнергии к минимуму.
Идея авторов проекта — с помощью энергии солнца и ветра снизить стоимость производства электроэнергии и по возможности обеспечить регулярную и бесперебойную её подачу, сведя при этом к минимуму вредные выбросы во внешнюю среду. Дополнительное преимущество такого подхода — возможность использования «чистого» аммиачного топлива не только для генерации электричества, но и для других целей, например, заправки доработанных лодочных моторов и привода различных механизмов. Во время испытаний в Калифорнии экспериментальный мотор более 1000 часов приводил в движение ирригационный насос, работая на смеси, состоящей из 75% аммиака и 25% пропана. Мощность этого шестицилиндрового мотора — около 100 л. с., КПД — порядка 50%.

Ещё одна интересная идея авторов проекта — размещать на морских и речных баржах крупные рефрижераторные аммиачные резервуары атмосферного давления, к которым будут подключены установки SSAS. Благодаря этому значительно упростится и удешевится доставка топлива в те районы, где оно в данный момент нужнее всего.
В ограниченном масштабе применяют способ взаимодействия водяного пара с фосфором и термического разложения углеводородов:
СН4 (1000 °С) = С + 2 Н2 (выделяется в виде газа).
В некоторых случаях водород получают в результате каталитического расщепления метанола с водяным паром
или в результате каталитического термического разложения аммиака
Однако эти исходные соединения получают в больших масштабах из водорода; между тем получение из них водорода является особенно простым и может быть использовано в таких производствах, которые потребляют его в сравнительно малых количествах (менее 500 м 3 /сутки).
Важнейшие методы получения водорода.
1. Растворение цинка в разбавленной соляной кислоте
Этот способ чаще всего применяют в лабораториях.
Вместо соляной кислоты можно также использовать разбавленную серную кислоту; однако если концентрация последней слишком высока, то выделяющийся газ легко загрязняется SO2 и H2 S. При использовании не вполне чистого цинка образуются ещё и другие соединения, загрязняющие водород, например AsH3 и PH3 . Их присутствие и обусловливает неприятный запах получаемого этим способом водорода.
Для очистки водород пропускают через подкисленный раствор перманганата или бихромата калия, а затем через раствор едкого кали, а также через концентрированную серную кислоту или через слой силикагеля для освобождения от влаги. Мельчайшие капельки жидкости, захваченные водородом при его получении и заключённые в пузырьках газа, лучше всего устранять при помощи фильтра из плотно спрессованной обычной или стеклянной ваты.
Если приходится пользоваться чистым цинком, то к кислоте необходимо добавить две капли платинохлористоводородной кислоты или сернокислой меди, иначе цинк не вступает в реакцию.
2. Растворение алюминия или кремния в едкой щёлочи
2 Al + 2 NaOH + 6 H2 O = 2 Na[Al(OH)4 ] + 3 H2
Эти реакции применяли раньше для получения водорода в полевых условиях (для наполнения аэростатов). Для получения 1 м 3 водорода (при 0 °С и 760 мм рт. ст.) требуется только 0,81 кг алюминия или 0,63 кг кремния по сравнению с 2,9 кг цинка или 2,5 кг железа.
Вместо кремния также применяют ферросилиций (кремниевый метод). Смесь ферросилиция и раствора едкого натра, введённая в употребление незадолго до первой мировой войны во французской армии под названием гидрогенита, обладает свойством после поджигания тлеть с энергичным выделением водорода по следующей реакции:
3. Действие натрия на воду
2 Na + 2 H2 O = 2 NaOH + H2
Ввиду того, что чистый натрий реагирует в этом случае слишком энергично, его чаще вводят в реакцию в виде амальгамы натрия; этот способ применяют преимущественно для получения водорода, когда им пользуются для восстановления "in statu nascendi". Аналогично натрию с водой реагируют и остальные щелочные и щелочноземельные металлы.
4. Действие гидрида кальция на воду
Этот метод является удобным способом получения водорода в полевых условиях. Для получения 1 м 3 водорода теоретически необходимо 0,94 кг СаН 2 и, кроме воды, не требуется никаких других реактивов.5. Пропускание водяного пара над раскалённым докрасна железом
При помощи этой реакции в 1783 г. Лавуазье впервые аналитически доказал состав воды. Образующийся при этой реакции оксид железа нетрудно восстановить до металлического железа, пропуская над ним генераторный газ так, что пропускание водяного пара над одним и тем же железом можно провести произвольное число раз. Этот метод долгое время имел большое промышленное значение. В небольших масштабах его применяют и в настоящее время.
6. Пропускание водяного пара над коксом.
При температуре выше 1000 °С реакция идёт главным образом по уравнению
Вначале получают водяной газ, т. е. смесь водорода и монооксида углерода с примесью небольших количеств углекислого газа и азота. От углекислого газа легко освобождаются промыванием водой под давлением. Монооксид углерода и азот удаляют при помощи процесса Франка-Каро-Линде, т. е. сжижением этих примесей, что достигается охлаждением жидким воздухом до -200 °С. Следы СО удаляют, пропуская газ над нагретой натронной известью
СО + NaOH = HCOONa — формиат натрия.
Этот метод даёт очень чистый водород, который используют, например, для гидрогенизации жиров.
Чаще, однако, водяной газ в смеси с парами воды при температуре 400 °С пропускают над соответствующими катализаторами, например над оксидом железа или кобальта (контактный способ получения водяного газа). В этом случае СО реагирует с водой по уравнению
Образующийся при этом СО2 поглощается водой (под давлением). Остаток монооксида углерода (
1 об. %) вымывают аммиачным раствором однохлористой меди. Применяемый в этом способе водяной газ получают пропусканием водяного пара над раскалённым коксом. В последнее время всё больше используют взаимодействие водяного пара с пылевидным углём (превращение угольной пыли в газы). Полученный таким способом водяной газ содержит обычно большое количество водорода. Выделяемый из водяного газа водород (содержащий азот) применяют главным образом для синтеза аммиака и гидрирования угля.
7. Фракционное сжиженнее коксового газа.
Подобно получению из водяного газа, водород можно получать фракционным сжижением коксового газа, основной составной частью которого является водород.
Сначала коксовый газ, из которого предварительно удаляют серу, очищают от СО2 промыванием водой под давлением с последующей обработкой раствором едкого натра. Затем постепенно освобождают от остальных примесей ступенчатой конденсацией, проводимой до тех пор, пока не остаётся только водород; от других примесей его очищают промыванием сильно охлаждённым жидким азотом. Этот метод применяют главным образом, чтобы получить водород для синтеза аммиака.
8. Взаимодействие метана с водяным паром (разложение метана).
Метан взаимодействует с водяным паром в присутствии соответствующих катализаторов при нагревании (1100 °С) по уравнению
СН4 + Н2 Опар + 204 кДж (при постоянном давлении).
Необходимое для реакции тепло следует подводить или извне, или применяя "внутреннее сгорание", т. е. подмешивая воздух или кислород таким образом, чтобы часть метана сгорала до диоксида углерода
СН4 + 2 О2 = СО2 + 2 Н2 Опар + 802 кДж (при постоянном давлении).
При этом соотношение компонентов выбирают с таким расчётом, чтобы реакция в целом была экзотермичной
12 СН4 + 5 Н2 Опар + 5 О2 = 29 Н2 + 9 СО + 3 СО2 + 85,3 кДж.
Из монооксида углерода посредством "конверсии СО" также получают водород. Удаление диоксида углерода производят вымыванием водой под давлением. Получаемый методом разложения метана водород используют главным образом при синтезе аммиака и гидрировании угля.
9. Взаимодействие водяного пара с фосфором (фиолетовым).
Обычно процесс проводят таким образом: пары фосфора, получающиеся при восстановлении фосфата кальция в электрической печи, пропускают вместе с водяным паром над катализатором при 400-600 °С (с повышением температуры равновесие данной реакции смещается влево). Взаимодействие образовавшейся вначале Н3 РО4 с фосфором с образованием Н3 РО3 и РН3 предотвращают быстрым охлаждением продуктов реакции (закалка). Этот метод применяют прежде всего, если водород идёт для синтеза аммиака, который затем перерабатывают на важное, не содержащее примесей удобрение — аммофос (смесь гидро- и дигидрофосфата аммония).
10. Электролитическое разложение воды.
Чистая вода практически не проводит тока, поэтому к ней прибавляются электролиты (обычно КОН). При электролизе водород выделяется на катоде. На аноде выделяется эквивалентное количество кислорода, который, следовательно, в этом методе является побочным продуктом.
Получающийся при электролизе водород очень чист, если не считать примеси небольших количеств кислорода, который легко удалить пропусканием газа над подходящими катализаторами, например над слегка нагретым палладированным асбестом. Поэтому его используют как для гидрогенизации жиров, так и для других процессов каталитического гидрирования. Водород, получаемый этим методом довольно дорог.
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".
Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т.

В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.

Рис. 1. Получение аммиака промышленным путём.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O;
- NH4OH ↔ NH3↑ + H2O.

Рис. 2. Получение аммиака в лаборатории.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.

Рис. 3. Производство удобрений.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.